SI-Einheiten
SI-System
International hat man sich auf ein einheitliches Mass-System geeinigt, das SI-System (Systeme International d’Unités). Für einige Länder ist die Einführung des SI-Systems ein noch nicht abgeschlossener Prozess. In dieser Druckschrift wird das SI-System zugrunde gelegt. Wo es aber aus traditionellen oder anderen Gründen sinnvoll erscheint, werden auch noch Angaben im metrischen System oder anderen gebräuchlichen Einheiten aufgeführt. Die nachfolgende Tabelle führt die SI-Einheiten und andere gebräuchliche Einheiten für die Zustandsgrößen, die in dieser Druckschrift zur Anwendung kommen, auf.
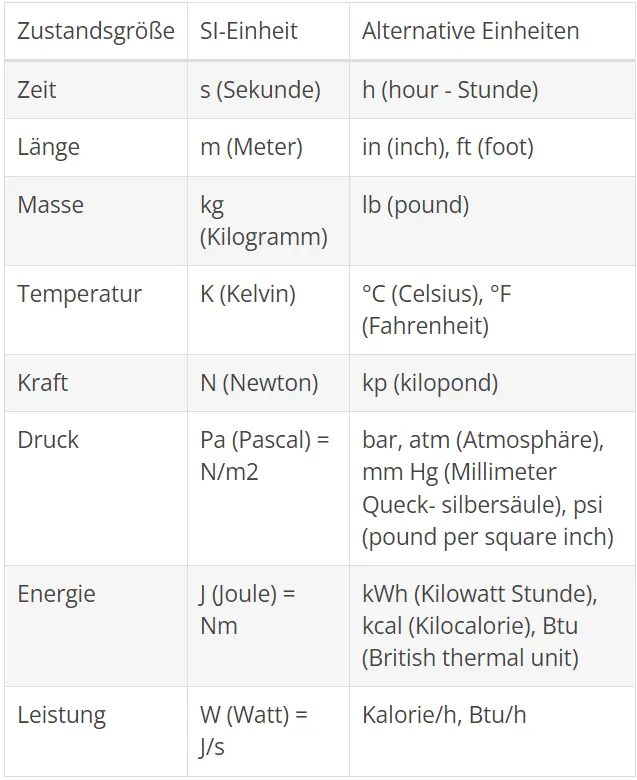
Die praktische Anwendung der SI-Einheiten ist nachhaltig verbunden mit der Anwendung der dezimalen Vielfachen und vermeidet entweder sehr kurze oder lange Zahlen. Eine Anzahl der gebräuchlichsten dezimalen Vielfachen entnehmen Sie bitte der nachfolgenden Tabelle. Beispiel:, Der atmosphärische Luftdruck ist 101325 Pa. Bei Gebrauch der dezimalen Vielfachen entsprechend der nachfolgenden Tabelle, wäre die beste Lösung 101,325 kPa zu schreiben. Die Auswahl der Vielfachen ist “frei”, doch die beste Auswahl wird normalerweise sein, einen Wert in einem Bereich zwischen 0,1 und 999,9 anzugeben. Vielfache können nicht benutzt werden für kombinierte SI-Einheiten - mit Ausnahme wenn [kg] benutzt wird. Beispiel: 2000 W/m2K und nicht als 2 kW/m2K.

Temperatur
Temperatur ist eine zentrale Eigenschaft in der Kältetechnik. Geradezu alle Kältemittelsysteme haben Reduktion der Temperatur eines Objektes, wie z.B. die Luft in einem Raum oder in einem Raum gelagerte Güter, zum Ziel.
In Kältemittelsystemen wird die Temperatur in Grad Celsius [°C] angegeben. Celsius ist keine absolute Temperaturskala, sondern der Referenzpunkt (0 °C) ist definiert durch den Gefrierpunkt von Wasser.
Die SI-Einheit für Temperatur in Kelvin [K] ist eine absolute Temperatur, da der Referenzpunkt [0 K] die niedrigste Temperatur ist, die in der Theorie erreicht werden könnte. Der einzige Unterschied zwischen Kelvin und °Celsius ist der Referenzpunkt, d. h. dass eine Temperaturdifferenz von 1°C exakt der Temperaturdifferenz von 1 K entspricht. Wissenschaftlich werden in der Kältetechnik Temperaturdifferenzen in [K] anstatt in [°C] beschrieben. Diese Praxis verringert mögliche Verwechslungen von Temperaturen und Temperaturdifferenzen.
Kraft und Druck
Die SI-Einheit für Kraft ist Newton (N), welches aktuell einem [kg m/s2 ] entspricht. Wirkt eine Kraft auf eine Fläche, so ist ihr Einfluss abhängig von der Größe dieser Fläche. Ein überzeugendes Beispiel hierfür ist die Tatsache, dass man auf einer Schneedecke mit Skiern weniger tief einsinkt, als ohne. Sie verteilen nämlich das Gewicht über eine große Fläche, so dass das Gewicht pro Flächeneinheit relativ klein wird. Druck ist definiert als das Verhältnis zwischen Kraft und Fläche, auf die sie wirkt. In dem Beispiel mit den Skiern ist die Kraft (Schwerkraft) in beiden Fällen die gleiche, nur die Fläche ist unterschiedlich. Ohne Ski ist die Fläche klein und der Druck groß, mit Ski ist die Fläche groß und der Druck klein.
In der Kältetechnik ist Druck zumeist verknüpft mit Flüssigkeiten, die als Kältemittel verwendet werden. Wenn eine Substanz in flüssiger oder gasförmiger Form in einem geschlossenen Behälter aufbewahrt wird, übt das Gas einen Druck auf die Innenwände des Behälters aus. Der Druck des Gases auf die innere Oberfläche dividiert durch seine Fläche wird absoluter Druck genannt. Aus praktischen Gründen wird der Wert des Druckes hin und wieder angegeben als “Druck über Atmosphärendruck”- meint der Atmosphärendruck (1013 5 kPa = 1,013 bar) wird vom absoluten Druck subtrahiert. Der Druck über Atmosphärendruck wird häufig als Manometer Druck bezeichnet.
Die verwendete Einheit sollte wiederspiegeln, ob absoluter Druck oder Manometer Druck angegeben wird. Ein absoluter Druck ist angezeigt durch Verwendung eines Kleinbuchstabens “a” und ein Manometer Druck wird angezeigt durch einen Kleinbuchstaben “g”.
Beispiel: Der absolute Druck ist 10 bar(a), welcher umgerechnet zu einem Manometer Druck von (10 - 1,013) bar(g) ≈ 9 bar(g) wird. Diese Kombination von SI-Einheiten für Druck in [Pa] wird nicht empfohlen.
Andere gebräuchliche Einheiten für Druck sind mm Quecksilbersäule [mmHg] und Meter Wasserförderhöhe [mwg]. Letztere wird häufig in Verbindung mit Pumpen, als Indikator für die Höhe der Wassersäule, die die Pumpe generieren kann. Vakuum ist definiert als ein absoluter Druck von 0 Pa - doch da es nahezu unmöglich ist, die Bezeichnung“Vakuum”zu erreichen, ist es allgemein gebräuchlich einen Druck viel niedriger als Atmosphärendruck zu beschreiben. Beispiel: Der absolute Druck ist 0,1 bar (a), wird zu einem Manometer Druck umgerechnet von (0,1 - 1,013) bar(g) ≈ –0.9 bar(g) . Vakuum ist auch oft in Torr (1 Torr entspricht 133,3 Pa) angegeben oder auch in Millibar (ein tausendstel bar).
Wärme, Arbeit, Energie und Leistung
Wärme und Arbeit sind Energieformen, d.h. sie können zwischen Gegenständen oder Systemen übertragen werden. Die Übertragung von Wärme ist eng verbunden mit der Temperatur (oder Temperaturdifferenz), welche zwischen zwei oder mehr Gegenständen besteht. An sich wird Wärme immer übertragen von einem Objekt mit höherer Temperatur zu einem Objekt mit niedrigerer Temperatur. Erwärmen eines Topfes mit Wasser auf einer Herdplatte ist ein passendes, alltägliches Beispiel für Wärmeübertragung. Die Herdplatte wird heiß und die Wärme wird über den Topfboden zum Wasser hin übertragen. Die Wärmeübertragung zum Wasser bewirkt einen Temperaturanstieg des Wassers. Mit anderen Worten, erwärmen eines Objekts ist dasselbe wie Übertragen von Energie (Wärme) an das Objekt.
In vielen praktischen Anwendungen ist eine Reduzierung der Temperatur eines Objektes notwendig, anstatt einer Temperaturanhebung. Dem obigen Beispiel folgend kann dies nur mit einem Objekt erreicht werden, das eine niedrigere Temperatur hat, als das zu kühlende Objekt. Bringt man diese beiden Objekte in Kontakt, wird eine Wärmeübertragung veranlaßt weg von dem zu kühlenden Objekt, folglich sinkt die Temperatur. Mit anderen Worten, kühlen eines Objektes ist dasselbe wie Übertragung von Energie (Wärme) vom Objekt weg.
Die typische Übertragung von Arbeit erfolgt über eine mechanische Welle, die in einem elektrischen Motor rotiert oder in einer Verbrennungsmaschine. Andere Formen der Übertragung von Arbeit sind möglich, aber eine rotierende Welle ist die meist verbreitetest Methode, die in Kältemittelsystemen zur Anwendung kommt.
Wie erwähnt, sind sowohl Wärme als auch Arbeit Energieformen. Die Methoden zur Übertragung zwischen Objekten sind unterschiedlich, doch in einem Prozess mit Übertragung von Wärme und Arbeit, ist es die Summe aus Übertragung von Wärme und Arbeit, die das Ergebnis des Prozesses bestimmt.
Die SI-Einheit Joule [J] wird angewandt, um Energie, Wärme und Arbeit zu bemessen. Die Energiemenge, die notwendig ist, um 1 kg Wasser von 15 °C auf 16 °C zu erwärmen ist 4,187 kJ. Diese 4,178 kJ können als Wärme oder Arbeit übertragen werden - doch wird Wärme die gebräuchlichste und geeignetste Lösung in diesem Prozess sein. Unterschiedliche Stoffe benötigen unterschiedliche Wärmemengen, um ihre Temperatur um 1 K zu erhöhen: 1 kg Eisen benötig 0,447 kJ, während 1 kg Luft etwa 1 kJ benötigt.
Die “spezifische Wärme” eines Stoffes ist die Wärmemenge, mit der 1kg um 1 K erwärmt werden kann. Sie ist für eine lange Reihe von Stoffen und Substanzen tabellarisch aufgeführt und hat die SI-Einheit J/kg K. Das Maß mit der Energie übertragen wird, nennt man Leistung. Die SI-Einheit für Leistung ist Watt (W).
Beispiel: Wenn 10 J pro Sekunde übertragen werden, ist das Maß der Energieübertragung mit 10 J/s = 10 W angegeben. Im SI-System ist die Auswahl der Einheit für Leistung die gleiche wie für Übertagung von Wärme und Arbeit. In anderen Systemeinheiten hat die Übertragung von Wärme und Arbeit unterschiedliche Einheiten.
Zustandsänderungen
Alle Substanzen können in drei Aggregatzuständen vorkommen: Fest, flüssig oder gasförmig. Das bekannteste Beispiel ist Wasser: In festem Zustand tritt es als Eis auf, in gasförmigem Zustand als Dampf, während wir es in seiner flüssigen Form überall in unserem Leben begegnen. Für Wasser haben die drei Phasen unterschiedliche Bezeichnungen - welches es etwas schwierig macht, es als eine Modellsubstanz zu betrachten. Die feste Form wird Eis genannt, die flüssige Form nennen wir einfach Wasser und die gasförmige Form wird als Wasserdampf bezeichnet. All diese Zustandsformen haben eines gemeinsam: Das Wassermolekül tritt in unveränderlicher Form auf; d.h. dass Eis, Wasser und Wasserdampf mit derselben molekularen Bezeichnung benannt werden können: H2O. Wenn eine Substanz von der festen Phase in die flüssige Phase übertritt, nennt man diesen Prozess schmelzen (verflüssigen) und wenn er weiter in die gasförmige Phase wechselt, spricht man von sieden (verdampfen). Geht es in die umgekehrte Richtung; eine gasförmige Substanz tritt in die flüssige Phase ein, nennt man das kondensieren, wenn sie weiter in die feste Phase wechselt, nennt sich der Prozess gefrieren (verfestigen).
Bei konstantem Druck weist der Übergangsprozess eine signifikante Eigenschaft auf. Wenn Eis bei 1bar erwärmt wird, steigt seine Temperatur bis zum Erreichen von 0 °C an - dann beginnt das Eis zu schmelzen.Während des Schmelzprozesses ändert sich die Temperatur nicht - alle Energie, die in das Eis / Wasser-Gemisch übertragen wird, wird dazu verwendet, das Eis zu schmelzen und nicht um das Wasser zu erwärmen. Erst wenn das Eis komplett geschmolzen ist, wird die weitere Energieübertragung eine Temperaturerhöhung bewirken.
Die gleiche Art der Reaktion kann beobachtet werden, wenn Wasser in einem offenen Topf erhitzt wird. Die Wassertemperatur steigt an, bis sie 100°C erreicht hat, dann beginnt die Verdampfung.Während des Verdampfungsprozesses bleibt die Temperatur auf 100 °C. Erst wenn alle Flüssigkeit verdampft ist, steigt die Temperatur des restlichen Wasserdampfes an.
Temperatur und Druck bestimmen, ob eine Substanz in festem, flüssigem oder gasförmigem Zustand vorkommt - oder in zwei oder in allen drei Zuständen. In unserer Umwelt kommt Eisen in seinem festen Zustand, Wasser fest, flüssig und gasförmig sowie Luft in seinem gasförmigen Zustand vor.
Verschiedene Substanzen haben unterschiedliche Schmelz- und Siedepunkte; z.B. Gold schmilzt bei 1064 °C, Schokolade bei 26 °C und die meisten Kältemittel schmelzen bei Temperaturen um -100 °C. Ob eine Substanz, in zwei seiner Phasen zur gleichen Zeit auftritt - oder eine Phasenänderung durchmacht- ist von Druck und Temperatur abhängig. Wenn die zwei Phasen in einem geschlossen Gefäß auftreten und sich beide Phasen in einem thermischen Beharrungszustand befinden, gilt der Zustand als gesättigt. Wenn die Temperatur der Zwei-Phasen-Mischung ansteigt, steigt auch der Druck im Gefäß an. Die Verknüpfung zwischen Druck und Temperatur für den gesättigten Zustand (Flüssigkeit und Dampf ) wird üblicherweise als Dampf-Druck-Kurve bezeichnet. Mittels Dampf-Druck-Kurve ermittelt man den Druck bei Verdampfung oder Verflüssigung.
Latente Wärme
Zum Prozess der Eisschmelze ist wichtig anzumerken, dass die Menge an Energie, die übertragen werden muss, um 1 kg Eis zu schmelzen, viel höher ist als die benötigte Energie, um die Temperatur von 1 kg Eis um z.B. 1 K zu erhöhen. In Abschnitt .4 war die spezifische Wärmemenge für Wasser mit 4,187 kJ/kg K angegeben. Die Energie um 1 kg Eis zu schmelzen ist 335 kJ. Der gleiche Betrag an Energie, der 1 kg Eis schmilzt, kann die Temperatur von 1 kg Wasser auf (335 kJ/4,187 kJ/kg K) = 80 K erwärmen!
Zurück zum Prozess des Wassersiedens, hier wäre die benötigte Energie zur Verdampfung von 1 kg Wasser 501 kJ. Der gleiche Betrag an Energie, der 1 kg Wasser verdampft, kann die Temperatur nicht von 1 kg, jedoch von 6 kg auf 100 °C erhitzen!
Diese Beispiele zeigen, dass Energieübertragung bezogen auf die Übergangsprozesse zwischen den Phasen von Bedeutung ist. Aus diesem Grunde wird Eis zum Kühlen benutzt man benötigt eine große Menge an Energie um das Eis zu schmelzen, und während dessen bleibt die Temperatur bei 0 °C. Der Kälteeffekt in Kältemittelsystemen basiert auf der kontrollierten Anwendung der Phasenänderung im Verdampfungsprozess. Wenn das Kältemittel verdampft, absorbiert es Energie (Wärme) aus seiner Umgebung. Durch thermischen Kontakt eines Objektes mit dem verdampfenden Kältemittel wird es abkühlt.
Überhitzung
Überhitzung ist ein wichtiger Begriff im Vokabular der Kältetechnik - doch wird es bedauerlicherweise unterschiedlich benutzt. Es kann einen Prozess beschreiben, in dem Kältemitteldampf in gesättigten Zustand auf eine höhere Temperatur erhitzt wird. Kann aber auch dazu verwendet werden, das Ende des zuvor beschriebenen Prozesses zu beschreiben.
Überhitzung kann erklärt werden als eine Temperaturdifferenz - zwischen der Temperatur gemessen mit einem Thermometer und der Sättigungstemperatur des Kältemittels gemessen mit einem Manometer. Aus diesem Grunde kann die Überhitzung nicht mit Hilfe einer einfachen Temperaturmessung allein festgelegt werden - eine Messung des Druckes oder der Sättigungstemperatur wird außerdem benötigt.
Wenn eine Überhitzung zahlenmäßig bestimmt ist, muss sie als eine Temperaturdifferenz angegeben werden, und das konsequenter weise mit der Einheit [K]. Wird sie in [°C] angegeben, kann die Fehlerursache darin liegen, wo die Temperatur für die Überhitzungsangabe gemessen wurde oder umgekehrt.
Der Verdampfungsprozess eines Kältemittelsystems ist einer der Prozesse, wo der Begriff Überhitzung benutzt wird. Dies wird nachfolgend näher erläutert.
Kältetechnische Diagramme
Die Charakteristiken eines Kältemittels können in einem Diagramm erklärt werden, mit Hilfe dessen Abszisse und Ordinate die relevanten Eigenschaften erläutert werden. Die wichtigsten Eigenschaften für Kältemittelsysteme sind normalerweise Energieinhalt und Druck. Die thermodynamische Eigenschaft “spezifische Enthalpie” steht für den Energieinhalt - bewertet durch die Änderung des Energieinhaltes per Maßeinheit des Kältemittels ausgesetzt in einem Prozess eines Kältemittelsystem.
Ein Diagrammbeispiel, basierend auf die spezifische Enthalpie (Abszisse) und dem Druck (Ordinate), kann nachfolgend eingesehen werden. Der für ein Kältemittel typisch anwendbare Druckbereich ist groß - daher benötigen Diagramme eine logarithmische Skala für den Druck.
Das Diagramm ist so angeordnet, dass es Flüssigkeit, Dampf und den Mischbereich des Kältemittels auf- zeigt. Flüssigkeit ist links (mit einem niedrigen Energieinhalt) und Dampf rechts (mit einem hohen Energieinhalt) zu finden. Zwischen den beide befindet der Mischbereich. Die Bereiche sind begrenzt durch eine Linie - der so genannten Sättigungslinie. Die wesentlichen Prozesse von Verdampfung und Verflüssigung sind damit erklärt.
Die Idee, solch ein kältetechnisches Diagramm zu verwenden, ist, den Prozess in einem Kältesystem in einer Weise darzustellen, dass Analyse und Auswertung des Prozesses einfacher werden. Bei Verwendung eines Diagramms sind Systembetriebsbedingungen (Temperatur und Druck), in relativ einfacher und schneller Art und Weise zu ermitteln. Diagramme werden nach wie vor zur Analyse eines Kälteprozesses anwendet. Dennoch stehen neuerdings eine Anzahl von PC Auswahlprogrammen zur Verfügung, mit denen die gleiche Analyse schneller und mit mehr Details ausführt werden kann.








